El origen molecular del control de los ritmos circadianos (los cambios fisiológicos que transcurren durante el día) ha recibido el Premio Nobel de Fisiología o Medicina de 2017, siendo los galardonados Jeffrey C. Hall (n. 1945, EE.UU.), Michael Rosbash (n. 1944, EE.UU.) y Michael W. Young (n. 1949, EE.UU.). En 1984, Hall y Rosbash, en la Univ. de Brandeis, Boston, y Young, en la Univ. Rockefeller, New York, aislaron el gen period en la mosca de la fruta, que produce la proteína PER que se acumula en las células durante la noche y que se degrada durante el día. Esta proteína cuyos niveles oscilan con un ritmo de unas 24 horas suprime la expresión del gen period, lo que genera una oscilación sostenida (autooscilación) que es responsable de los ritmos circadianos.
Por supuesto, la bioquímica de los ritmos circadianos es mucho más complicada que un simple bucle realimentado negativo (o inhibitorio). En 1994, Young descubrió un segundo gen circadiano, timeless, que codifica la proteína TIM que se acopla a PER para permitir su paso desde el citoplasma al núcleo, donde bloquear la producción de esta proteína durante el día. Estudios posteriores descubrieron muchos otros detalles del control de los ciclos circadianos. Lo importante de estos estudios en moscas es que también se aplican a los humanos (muchos hemos sufrido el jet lag en alguna ocasión). Por ello su estudio tiene gran importancia biomédica, sobre todo en la actualidad con los ritmos de vida que sufrimos todos los días.
Más información en el anuncio del premio, la nota de prensa, y la información científica avanzada. Los artículos científicos clave que han sido premiados son W. A. Zehring, …, M. Rosbash, J. C. Hall, «P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster,» Cell 39: 369–376 (1984), doi: 10.1016/0092-8674(84)90015-1; T. A. Bargiello, F. R. Jackson, M. W. Young, «Restoration of circadian behavioural rhythms by gene transfer in Drosophila,» Nature 312: 752–754 (1984), doi: 10.1038/312752a0; K. K. Siwicki, …, M. Rosbash, J. C. Hall, «Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system,» Neuron 1: 141–150 (1988), doi: 10.1016/0896-6273(88)90198-5; P. E. Hardin, J. C. Hall, M. Rosbash, «Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels,» Nature 343: 536–540 (1990), doi: 10.1038/343536a0; X. Liu, …, J. C. Hall, M. Rosbash, «The period gene encodes a predominantly nuclear protein in adult Drosophila,» Journal of Neuroscience 12: 2735–2744, (1992); L. B. Vosshall, J. L. Price, …, M. W. Young, «Block in nuclear localization of period protein by a second clock mutation, timeless,» Science 263: 1606–1609 (1994), doi: 10.1126/science.8128247; y J. L. Price, J. Blau, …, M. W. Young, «double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation,» Cell 94, 83–95 (1998), doi: 10.1016/S0092-8674(00)81224-6.
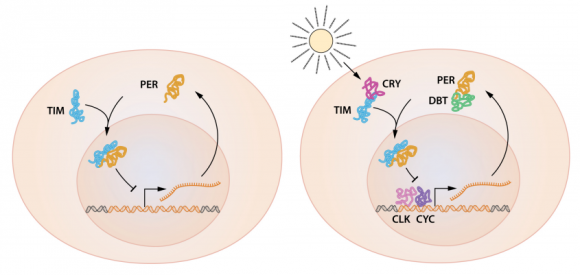
Los estudios galardonados este año, como ya suele ser habitual, aparecen en los libros de texto de Bioquímica y Biología Molecular como un ejemplo paradigmático del comportamiento oscilatorio autosostenido en redes metabólicas. Ya en 1971, Seymour Benzer and Ronald Konopka identificaron mutantes de la mosca de la fruta con ritmos circadianos alterados y ofrecieron la hipótesis de que había un gen responsable, que luego se llamó period. Tras una década de investigación dicho gen (su secuencia de nucleótidos) fue identificado por los galardonados, pero fue necesario mucho más trabajo para desvelar los detalles de su funcionamiento. Las proteínas PERIOD (PER) y TIMELESS (TIM), como muestra esta figura simplificada, producen una oscilación sostenida que hoy (en la era de la Biología Sintética y de la Biología Sistémica) nos parece casi obvia, pero que en su momento fue un descubrimiento revolucionario.
Los ritmos circadianos (observados en plantas en 1729 por el astrónomo francés Jean Jacques d’Ortous) controlan nuestros patrones de sueño, la temperatura corporal, la presión sanguínea, el metabolismo y ciertos ciclos hormonales. Como es obvio los detalles son mucho más complicados que el esquema básico descubierto por Hall, Rosbash y Young, un bucle realimentado negativo de transcripción-traducción (Transcription-Translation Feedback Loop, o TTFL). La oscilación de los niveles de la proteína PER tiene su origen en la oscilación del ARNm asociado al gen period (necesario para su traducción), y esta tiene su origen en el control de la expresión de dicho gen (necesario para su transcripción) vía la propia proteína PER que actúa como factor de transcripción. Para ello esta proteína tiene que entrar dentro del núcleo, lo que requiere su acoplamiento a la proteína TIM. El descubrimiento de estos mecanismos moleculares en los 1980 y principios de los 1990 requería el uso de mutantes.
La activación de la transcripción de los genes period y timeless depende de los productos de otros dos genes, clock y cycle, las proteínas CLOCK (CLK) y CYCLE (CYC). Esta proteínas forman parte de un bucle de control con realimentación positiva para la transcripción de TIM y PER, que a su vez actúan en un bucle de control con realimentación negativa para la transcripción de CLK y CYC. Por supuesto, hay otras piezas en el puzzle de los ritmos circadianos, como el gen doubletime que produce la quinasa DOUBLETIME (DBT) que fosforila a PER e incrementa su degradación, o la proteína CRY producida por el gen cry que se acopla a TIM para su degradación en el proteasoma. La regulación de los ritmos circadianos es resultado de una exquisita pieza de ingeniería metabólica digna de un relojero suizo.
La cronobiología tiene un impacto relevante en nuestra salud. Los ritmos circadianos controlan la gluconeogénesis (biosíntesis de glucosa), la sensibilidad a la insulina y la oscilación sistemática de los niveles de glucosa en sangre, entre otras cosas. Pero lo que más destaca son los transtornos asociados al sueño y la función normal del encéfalo. Su efecto se ha asociado a estados de depresión, a la función cognitiva, al desorden bipolar, a la formación de la memoria y otros transtornos neurológicos. Por ello hay muchos esfuerzos farmacológicos para tratar de controlar la cronobiología humana con énfasis en mejorar nuestra salud. Estas aplicaciones biomédicas justifican que los pioneros Hall, Rosbash y Young hayan sido galardonados con el Premio Nobel de Medicina de 2017.