Todo el mundo lo sabe: las proteínas «viven» en un medio acuoso que fluctúa constantemente. Pocos lo tienen en cuenta. La mayoría de los libros de texto muestran las proteínas en una única conformación y «desnudas». El «dogma» en bioquímica es una conformación (forma), una función. Este «dogma» es como el borracho que pierde las llaves y las busca debajo de la farola, porque allí hay luz. Tanto la función proteíca como su plegamiento y conformación están dominados por los efectos de las fluctuaciones del disolvente (que es polar en el caso del agua), como han demostrado Hans Frauenfelder, de Los Alamos National Laboratory, EE.UU., y sus colaboradores, quienes han estudiado la mioglobina en medio acuoso tanto experimental como teóricamente. El modelo «hidratado» permite explicar mejor la dependencia con la temperatura y con el tiempo del paso de monóxido carbónico a través de la mioglobina, explicando la dependencia no exponencial del tiempo de relajación tras su fotodisociación. Lo han publicado en Hans Frauenfelder et al. «A unified model of protein dynamics,» PNAS, Published online before print February 27, 2009 (es gratuito, open access).
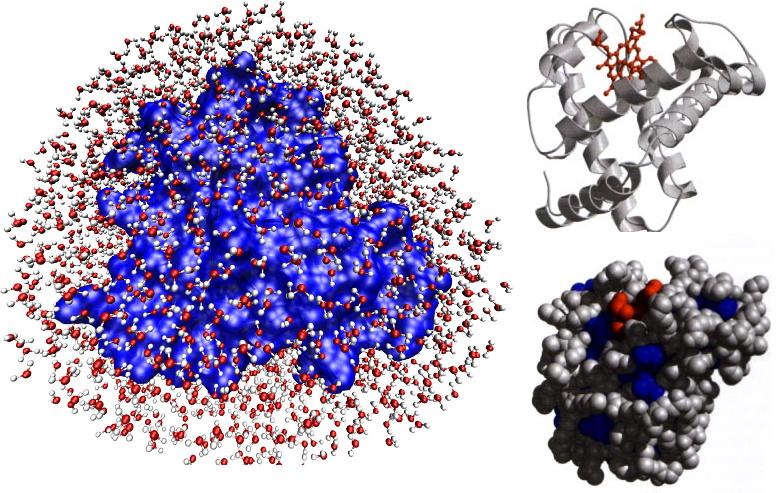
La figura de arriba-derecha, extraída del artículo, muestra la mioglobina (globular) rodeada de una capa de moléculas de agua, utilizada en las simulaciones por ordenador. Las figuras de arriba-izquierda muestran como se estudia la molécula normalmente (figuras extraídas del famoso libro de Lehninger).
Las proteínas son sistemas dinámicos que interactúan fuertemente con su entorno. La mayoría de los libros de texto muestran las proteínas en una única conformación y «desnudas», sin su envoltura de hidratación ni el disolvente en el que están disueltas, y mucho menos se mencionana las fluctuaciones de estos. Esta visión «pasiva» de la molécula contrasta con la visión «dinámica» que Frauenfelder y sus colaboradores proponen en lo que llaman su modelo unificado de la dinámica proteíca.
 Las fluctuaciones del disolvente potencian y controlan los movimientos a gran escala y los cambios de forma (conformación) de la proteína. Además, los movimientos de la envolvente hidratada de la molécula potencian y controlan los movimientos internos de la proteína, como la migración de ligandos. En el caso de la mioglobina, estudiada por los autores, la envolvente hidratada está formada por 2 capas de moléculas de agua, con más de 200 moléculas, y es importante recordar que la versión no hidratada de la molécula no funciona. Más aún, durante la función proteíca, la forma (conformación) de la proteína no es única, sino que sufre importantes cambios, en gran parte influidos por las propias fluctuaciones del disolvente y de la envolvente hidratada.
Las fluctuaciones del disolvente potencian y controlan los movimientos a gran escala y los cambios de forma (conformación) de la proteína. Además, los movimientos de la envolvente hidratada de la molécula potencian y controlan los movimientos internos de la proteína, como la migración de ligandos. En el caso de la mioglobina, estudiada por los autores, la envolvente hidratada está formada por 2 capas de moléculas de agua, con más de 200 moléculas, y es importante recordar que la versión no hidratada de la molécula no funciona. Más aún, durante la función proteíca, la forma (conformación) de la proteína no es única, sino que sufre importantes cambios, en gran parte influidos por las propias fluctuaciones del disolvente y de la envolvente hidratada.
Los cambios en forma (conformacionales) de la proteína se pueden representar en un espacio de energía (energy landscape). Cada posible conformación de la proteína viene caracterizada por un mínimo local de energía, los picos que muestra la figura (A) de la izquierda (con muchos picos localizados en mínimos más anchos). Durante la función bioquímica de la proteína, se producen fluctuaciones conformacionales (ilustradas en la figura (B) de la izquierda) que se pueden representar como un movimiento de un punto a otro en el espacio energético de conformaciones (en la figura, una proyección bidimensional del espacio «real» que tiene cientos de dimensiones). Estos movimientos son similares a caminos aleatorios en este espacio y dos proteínas no siguen exactamente el mismo camino (luego no tienen exactamente la misma estructura). Por ello se han de aplicar técnicas estadísticas para promediar el comportamiento de una muestra de proteínas observada en experimentos.
Pronto, los libros de texto de bioquímica tendrán que ser cambiados para incorporar los descubrimientos de este interesante artículo, cuya lectura recomiendo a todos los estudiantes y/o profesores de bioquímica (aprovechad que es de acceso gratuito). El «sacrosanto» de una conformación, una función, es como el borracho que pierde las llaves y las busca debajo de la farola, porque allí hay luz.

