
El microscopio de efecto túnel y el microscopio de fuerza atómica permiten ver átomos y moléculas colocados en una superficie, pero no pueden ver su distribución de carga eléctrica. Para ello se puede utilizar el microscopio de fuerza atómica con sonda Kelvin (KPFM) que mide la diferencia de potencial local entre la punta de la sonda y la superficie. Por primera vez, se ha logrado observar la distribución de carga eléctrica de una molécula, en concreto, de la naftalocianina (Nc); lo ha logrado el laboratorio de IBM en Zurich, que ya logró hacer lo mismo con un átomo en 2009. Los resultados experimentales (figura d, obtenida combinando b y c) están en buen acuerdo con las predicciones teóricas (figura e). Las diferencias de potencial de contacto (DPC) entre la molécula y la sonda se miden de una forma curiosa; se pone a oscilar la punta del KPFM mientras se aplica un voltaje entre la muestra y dicha punta de forma que el campo eléctrico resultante compense la fuerza atómica en la punta; la compensación precisa requiere un bucle de control realimentado, del que se extrae la señal medida de la distribución de carga de la molécula. La técnica es más precisa en moléculas que tienen tautómeros ya que se mide de forma independiente cada uno de ellos y combinando los resultados se pueden eliminar defectos debidos a la orientación incorrecta de la punta del KPFM. El artículo técnico es Fabian Mohn, Leo Gross, Nikolaj Moll & Gerhard Meyer, «Imaging the charge distribution within a single molecule,» Nature Nanotechnology, Published online 26 February 2012. Me enteré de este artículo gracias a un tuit de César @EDocet que hacía referencia al artículo de «Single molecule’s electric charges seen in first image,» BBC News, 26 February 2012; he tomado el título de mi entrada de una de su nuevo blog, «La primera imagen de la distribución de carga de una sola molécula,» AAA+ por @EDocet, 27 feb. 2012.

En esta figura se aprecia la diferencia entre las diferentes técnicas de microscopia y los resultados obtenidos por ordenador. La figura (a) muestra la molécula de naftalocianina (Nc) en amarillo y una molécula de control de CO (el punto morado abajo a la izquierda). La figura (b) es una imagen por microscopio de efecto túnel (STM) de la molécula de Nc utilizando una punta terminada en una molécula de CO; en rojo se destacan las posiciones de los átomos de hidrógeno centrales. Las figuras (c) y (d) han sido obtenidas con un microscopio de fuerza atómica (AFM) con la punta a una altura constante, z = 0,145 nm en (c) y z = 0,175 nm en (d). Las figuras (e) y (f) muestran cortes de la distribución de densidad electrónica de la molécula calculada mediante ordenador utilizando la teoría del funcional de densidad (DFT); los cortes corresponden a distancias d = 0,2 nm en (e) y d = 0,3 nm en (f). Las figuras (g) y (h) muestran también resultados de simulaciones por ordenador mediante DFT para cortes de la molécula con distancias d = 0,1 nm en (g) y d = 0,4 nm en (h). Las barras blancas en estas figuras corresponden a 2 nm en (a) y 0,5 nm en todas las demás.
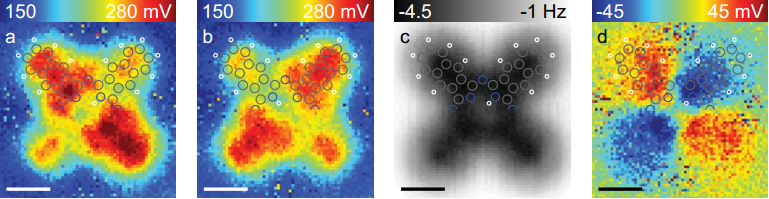
La razón por la que se ha utilizado la naftalocianina como molécula es la posibilidad de poder forzar su tautomerización para obtener una imagen más precisa. Las figuras (a) y (b) muestran imágenes de dos tautómeros de la Nc obtenidas con una punta terminada en CO a una altura constante de z = 0.2 nm (en la (a) está la molécula antes de la tautomerización y la (b) después de ella). La diferencia entre las imágenes (a) y (b) permite obtener la imagen (d) que representa la distribución de carga final de dicha molécula. La figura (c) muestra el resultado obtenido mediante simulaciones por ordenador utilizando DFT. La barra de escala en todas las figuras corresponde a 0,5 nm. En la figura (c) los átomos de carbono, hidrógeno y nitrógeno se han representado con círculos de color gris, blanco y azul, respectivamente.
Esta entrada participa en la XII Edición del Carnaval de la Química que organiza este mes el blog Historias con mucha química (como todas), cuya autora es María Docavo @MariaDocavo, almeriense, bloguera, Licenciada en Química, especialista en comunicación y periodismo científico y divulgadora de vocación.


¿Que no se puede? http://en.wikipedia.org/wiki/Electrochemical_scanning_tunneling_microscope
Y no veas lo que mola jugar cambiando la sondita y empleando la transformada de Fourrier. Es realmente divertido. Por cierto, el cacharrito tiene el aspecto de un escáner de los viejos, y el manual es infumable (y probablemente incorrecto a propósito).