Uno de los problemas más importantes del s. XXI es el problema del plegamiento de proteínas, determinar la estructura tridimensional (conformación terciaria) de una proteína a partir del listado de sus aminoácidos (codificados en su secuencia de ADN). Esta estructura nativa es única para la mayoría de las proteínas, determinando en gran parte su función bioquímica (la geometría determina la función). Se ha publicado en Nature un artículo que propone los principios básicos y las reglas fundamentales que controlan el plegamiento a partir de la estructura secundaria de las proteínas (las hélices α y las hojas β). Estos principios podrían usarse para diseñar nuevas proteínas que se plieguen de la forma deseada, lo que podría tener enormes aplicaciones en biología sintética.
Nos lo cuenta Birte Höcker, «Structural biology: A toolbox for protein design,» Nature 491: 204–205, 08 November 2012, que se hace eco de Nobuyasu Koga, Rie Tatsumi-Koga, Gaohua Liu, Rong Xiao, Thomas B. Acton, Gaetano T. Montelione, David Baker, «Principles for designing ideal protein structures,» Nature 491: 222–227, 08 November 2012.

La conformación nativa de una proteína es termodinámicamente estable y corresponde al plegamiento de menor energía. Los diferentes pliegues están unidos por enlaces covalentes, pero la conformación depende de los enlaces no covalentes, con lo que las proteínas tienen múltiples conformaciones de transición o no nativas. En el mapa del paisaje de conformaciones de la proteína en función de la energía, la proteína se pliega recorriendo un camino que la lleva hasta un mínimo energético. El gran problema de los métodos computacionales para determinar el plegamiento mediante ordenador es que este problema de minimización puede acabar en mínimos locales, conformaciones no nativas con una energía mínima localmente pero no globalmente, que pueden ser confundidas con la conformación nativa.

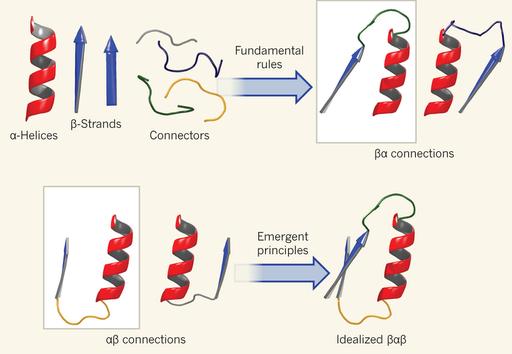
El nuevo artículo propone una serie de reglas sencillas que permiten diferenciar entre conformaciones nativas y no nativas, lo que ayuda a guiar a los programas de ordenador de plegamiento automático. Las reglas de la horquilla ββ, la del motivo αβ y la del motivo βα, así como las llamadas reglas ββα, αββ y βαβ. Lo sorprendente es que con un conjunto tan pequeño de reglas sencillas, los autores han sido capaces de reconstruir con éxito la conformación nativa de múltiples proteínas con entre 80 y 100 aminoácidos. Muchas proteínas más grandes utilizan estructuras de este tamaño como bloques de construcción, lo que sugiere que estas reglas pueden ser claves para la resolución del problema del plegamiento de proteínas.

Yo no soy experto en estas lides, pero este artículo me parece muy prometedor. Las reglas parecen bien justificadas (dependiendo de la quiralidad y las preferencias estructurales de las cadenas polipeptídicas). La incorporación de este tipo de reglas en los programas de diseño e ingeniería de proteínas podría tener implicaciones biomédicas y farmacológicas de enorme importancia. Pero, por ahora, con los pies en la tierra, estas nuevas reglas parecen ideales para ser descritas en libros de texto y para ser impartidas por los profesores de cursos de bioquímica avanzados que discutan con cierto detalle el plegamiento de las proteínas. Por supuesto, si alguno está leyendo esto, le animo a comentar su opinión al respecto.


Hola Francis, muy buen aporte, el plegamiento de proteínas es un tema fascinante (es mi área) de grandes implicaciones matemáticas, físicas, químicas, etc. y efectivamente como mencionas, este fenómeno es el santo grial de la biofísica dadas las implicaciones que tendría. Aunque me gustaría agregar, que en el plegamiento de proteínas, la estabilidad termodinámica no es siempre el factor dominante. La estabilidad cinética (relacionada con la barrera de energía libre que separa al estado nativo de las formas no nativas), ha demostrado ser un factor muy importante para entender la bases de la estabilidad proteica y esta a su vez importante para entender las bases de la funciones biológicas y la evolución molecular.
Y pues bueno, llevo mucho tiempo siguiendo tu blog (y me encanta) y me da mucho gusto que toques estos temas, que bueno que no hables siempre de temas de una misma área.
¡Saludos desde la ciudad de México!
Estas reglas pueden ser la clave para desatascar el cuello de bortella en que se encuentra la genomica. Puede ser decisiva para alcanzar el nivel en el que sea fácil producir proteinas a la carta y abrir una nueva era en medicina y biologia.
Saludos.
Wow, ¡qué artículo tan interesante!
Muchas gracias Francis, ya que no es tan fácil encontrar páginas de divulgación científica, y encima tan dedicadas e interesantes (creo que va unido). Además, me sirve mucho para saber qué se hace actualmente y de qué manera, cosa que nunca explican en clase… (tengo 15 años). De nuevo, muchas gracias.
Un saludo
Enhorabuena por tu blog, Francis. Me parece muy interesante y necesaria la labor que haces de divulgación. Me gustaría comentarte que en el primer párrafo mencionas código genético refiriéndote realmente a la secuencia de ADN (código genético es el conjunto de reglas que relaciona codones y aa).
Saludos!
Gracias, Carlos, lo cambio.