
Te recomiendo escuchar el podcast del episodio T03E04, «Investigación frente al coronavirus desde Málaga», 01 oct 2020 [10 min. 00:47:20–00:57:20], del programa de radio “Ciencia para todos”, en el que participo junto a Enrique Viguera (Universidad de Málaga), coordinador de Encuentros con la Ciencia. Esta sección semanal del programa “Hoy por Hoy Málaga” presentado hoy por Isabel Ladrón de Guevara, se emite todos los jueves en la Cadena SER Málaga (102.4 FM) entre las 13:05 y las 13:15. Enrique y yo hemos intervenido desde nuestras propias casas.
Entrevistamos a la Dra. Ana Grande Pérez en relación con su proyecto de investigación en mutagénesis letal contra el coronavirus SARS-CoV-2. Si te interesa el tema puedes disfrutar de sus artículos sobre mutagénesis letal contra otros virus, como Luis Díaz-Martínez, Isabel Brichette-Mieg, …, Ana Grande-Pérez, «Lethal mutagenesis of an RNA plant virus via lethal defection,» Scientific Reports 8: 1444 (2018), doi: https://doi.org/10.1038/s41598-018-19829-6; Rubén Agudo, …, Ana Grande-Pérez, Esteban Domingo, «Involvement of a joker mutation in a polymerase-independent lethal mutagenesis escape mechanism,» Virology 494: 257-266 (2016), doi: https://doi.org/10.1016/j.virol.2016.04.023; Ana M. Ortega-Prieto, …, Ana Grande-Pérez, …, Celia Perales, «Extinction of Hepatitis C Virus by Ribavirin in Hepatoma Cells Involves Lethal Mutagenesis,» PLoS ONE 8: e71039 (2013), doi: https://doi.org/10.1371/journal.pone.0071039; Héctor Moreno, Ana Grande-Pérez, …, Verónica Martín, «Arenaviruses and Lethal Mutagenesis. Prospects for New Ribavirin-based Interventions,» Viruses 4: 2786-2805 (2012), doi: https://doi.org/10.3390/v4112786; entre otros.
Otros artículos de interés sobre la mutagénesis letal que me han parecido relevantes son Everett Clinton Smith, Hervé Blanc, …, Mark R. Denison, «Coronaviruses Lacking Exoribonuclease Activity Are Susceptible to Lethal Mutagenesis: Evidence for Proofreading and Potential Therapeutics,» PLOS Pathogens 10: e1004342 (2013), doi: https://doi.org/10.1371/journal.ppat.1003565; Ashleigh Shannon, Barbara Selisko, …, Bruno Canard, «Rapid incorporation of Favipiravir by the fast and permissive viral RNA polymerase complex results in SARS-CoV-2 lethal mutagenesis,» Nature Communications 11: 4682 (17 Sep 2020), doi: https://doi.org/10.1038/s41467-020-18463-z; Andrea J. Pruijssers, Mark R. Denison, «Nucleoside analogues for the treatment of coronavirus infections,» Current Opinion in Virology 35: 57-62 (2019), doi: https://doi.org/10.1016/j.coviro.2019.04.002; Yuanyuan Ma, Lijie Wu, …, Zihe Rao, «Structural basis and functional analysis of the SARS coronavirus nsp14–nsp10 complex,» PNAS 112: 9436-9441 (2015), doi: https://doi.org/10.1073/pnas.1508686112; Enrique Santiago, Armando Caballero, «The value of targeting recombination as a strategy against coronavirus diseases,» Heredity 125: 169-172 (30 Jun 2020), doi: https://doi.org/10.1038/s41437-020-0337-5; A. Shannon, B. Selisko, …, B. Canard, «Favipiravir strikes the SARS-CoV-2 at its Achilles heel, the RNA polymerase,» bioRxiv preprint 098731 (15 May 2020), doi: https://doi.org/10.1101/2020.05.15.098731; Suranga L Senanayake, «Overcoming nonstructural protein 15-nidoviral uridylate-specific endoribonuclease (nsp15/NendoU) activity of SARS-CoV-2,» Future Drug Discovery 2: FDD42 (27 May 2020), doi: https://doi.org/10.4155/fdd-2020-0012; así como Jason D. Graci, Nina F. Gnädig, …, Craig E. Cameron, «Mutational Robustness of an RNA Virus Influences Sensitivity to Lethal Mutagenesis,» Journal of Virology 2869-2873 (2012), doi: https://doi.org/10.1128/JVI.05712-11; Guillaume Martin, Sylvain Gandon, «Lethal mutagenesis and evolutionary epidemiology,» Philosophical Transactions of the Royal Society B: Biological Sciences 365: 1953-1963 (2010), doi: https://doi.org/10.1098/rstb.2010.0058; entre otros.
Escucha «Investigación frente al coronavirus desde Málaga» [10 min. 00:47:20–00:57:20] en Play SER.
Isabel: Buenas tardes, Francis y Enrique, abrimos el programa de hoy hablando de nuevo del (dichoso) coronavirus, pero no de la pandemia, sino de los diferentes proyectos científicos encaminados al estudio del virus. Se dice que «la ciencia nos salvará del coronavirus», pero parece claro que «la ciencia no nos salvará sin que la salvemos». Francis, ¿cómo ves el apoyo de los gobiernos a la investigación científica durante la pandemia del coronavirus?
Francis: El coronavirus SARS-CoV-2 está considerado el «enemigo público número uno». «Todas las agencias de financiación de la investigación en el mundo han considerado prioritario la batalla contra este coronavirus. Y lo han hecho desde el principio, nada más comenzar la pandemia, abriendo diferentes convocatorias de financiación de proyectos para que los investigadores se centren en el estudio de diferentes aspectos de la biología del coronavirus y de la enfermedad que nos provoca, la COVID-19.
La verdad, Isabel, nunca antes se había dedicado un esfuerzo conjunto tan enorme y tan focalizado en un único objetivo común. Para combatir al «enemigo público número uno» desde España se han lanzado múltiples iniciativas de financiación; como el Fondo Covid-19, dependiente del Instituto de Salud Carlos III, el fondo CDTI para apoyar la investigación en empresas sobre COVID-19, dependiente del Ministerio de Ciencia e Innovación, la convocatoria para proyectos de investigación sobre el SARS-COV-2 y la enfermedad COVID-19, de la Junta de Andalucía cofinanciada con fondos FEDER, y muchas más iniciativas privadas. El CSIC (Consejo Superior de Investigaciones Científicas) ha puesto en marcha una Plataforma Temática Interdisciplinar (PTI) denominada Salud Global/Global Health, en la que colaboran más de 330 grupos de investigación de diferentes especialidades, para recabar donaciones privadas para la investigación en el coronavirus desde todos los puntos de vista posibles».
Enrique: «Así es Francis, hay del orden de 100 proyectos de investigación en marcha con objetivos diferentes con motivo de la pandemia. Hay proyectos enfocados a la prevención, Estudios en biología y comportamiento del virus, proyectos en diagnóstico, proyectos en desarrollo de vacunas, que quizá son los que oímos más en los medios, proyectos sobre epidemiología, tratamientos con fármacos, etc. Lo importante es que todos ellos van a generar conocimiento para soluciones y mejoras de aplicación inmediata sobre los pacientes y el sistema sanitario. No olvidemos que al SARS-CoV-2, causante de la COVID-19, es un virus nuevo y desconocemos muchos aspectos de su biología, aunque, como ya digo, se está avanzando a pasos agigantados gracias a esta colaboración internacional».
«Yo trabajo en genética, así que me gustaría destacar proyectos encaminados a estudiar el perfil genético de miles de pacientes afectados en España con el objetivo de determinar si existen variantes genéticas asociadas a los diferentes niveles de gravedad de la enfermedad que se han observado. También me gustaría destacar otros proyectos enfocados que estudian la variabilidad genética del virus y su relación con la gravedad de la enfermedad».
Isabel: Hoy tenemos entre nosotros, precisamente, a una investigadora de la Universidad de Málaga, la profesora Ana Grande, quien ya ha pasado en otras ocasiones por estos micrófonos hablando sobre virus y que acaba de recibir un proyecto de investigación para estudiar la evolución del coronavirus. [Saludo] Ana, uno de los temores que tenemos es que el virus mute hacia una forma más agresiva que implique un aumento del número de casos que cursan con síntomas graves. ¿cómo lo ves?
Ana Grande: «Los virus mutan; más aún, la mutación es inherente a la propia vida y a la evolución todos los seres vivos. Los virus son un caso extremo porque mutan mucho más que cualquier otra célula; además, los coronavirus como otros virus que tienen ARN como material genético mutan más que los que tienen ADN. Esta capacidad de mutación les permite adaptarse rápidamente y, por ejemplo, les otorga la capacidad de saltar de unas especies a otras especies, las llamadas zoonosis. Además, las mutaciones les dotan de la capacidad de escapar del sistema inmune y de luchar contra las defensas de las células; un buen ejemplo es el virus de la gripe, para el que tenemos que vacunarnos todos los años. Más aún, la variabilidad genética de los virus les permite adquirir resistencia contra tratamientos antivirales, como es el caso del virus del SIDA (VIH); para luchar contra este retrovirus se usan terapias combinadas con varios antivirales, para que sea más improbable que se desarrollen mutantes con varias resistencias simultáneas».
Isabel: Ana, ¿y podemos pensar lo contrario, que el virus mute hacia formas menos agresivas?
Ana Grande: «Las mutaciones son aleatorias, no sabemos dónde va a mutar un virus, pero lo habitual es que se favorezca la atenuación de la virulencia. Cuando los virus van pasando de una persona a otra se suele potenciar más la capacidad de transmisión que la virulencia, así que lo normal es que se atenúen. Pero, como es un proceso aleatorio, no se puede descartar que aparezca alguna forma que sea más grave. Pero, repito, lo normal es que los virus evolucionen a atenuarse favoreciendo su capacidad de multiplicación y de transmisión. Este proceso se ha visto con muchos virus, por ejemplo, hay tres tipos del virus de la gripe, llamados A, B y C, habiéndose visto que los de tipo C han evolucionado y ya no causan enfermedad».
Francis: Ana, ¿nos podrías contar de forma divulgativa cuál es el objetivo del proyecto de investigación que te han concedido?
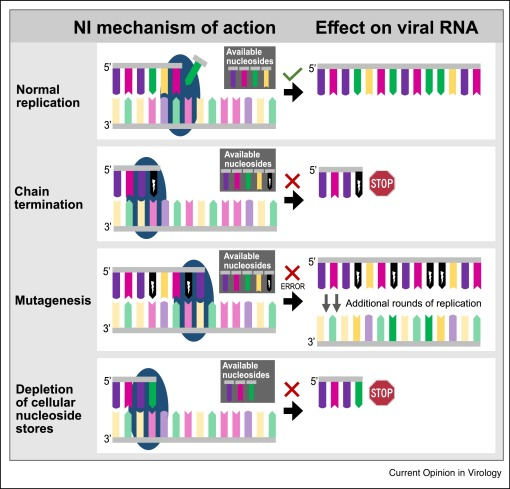
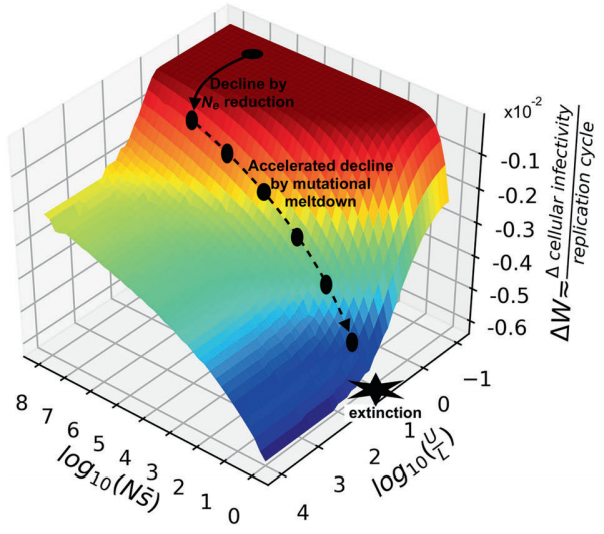
Ana Grande: «El proyecto que nos han concedido en la convocatoria de la Junta Andalucía es una terapia que se basa en una estrategia antiviral denominada mutagénesis letal. Esta estrategia antiviral se está investigando para distintos virus desde hace bastantes años. Se basa en el uso de compuestos mutagénicos, que provocan que durante la replicación del ARN del virus se produzcan muchas más mutaciones; en general, este exceso de mutaciones es incompatible con la vida. Todos los seres vivos tenemos un nivel de mutaciones que nuestro genoma puede tolerar; los virus tienen genomas más cortos con lo que toleran un mayor número de mutaciones».
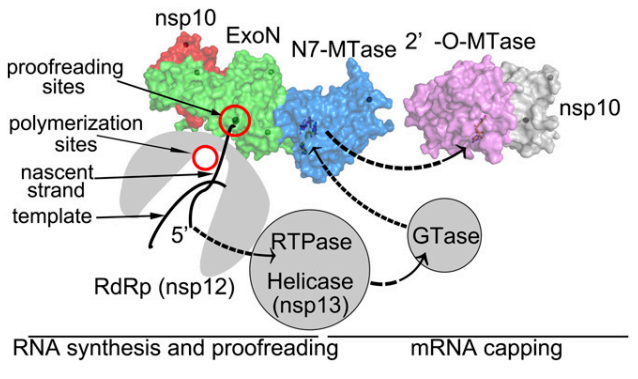
«La mutagénesis letal consiste en aumentar las mutaciones del virus, lo que ayuda a eliminarlo. Ya se ha demostrado que funciona en cultivos celulares contra una arenavirus; ahora queda trasladarlo a ensayos preclinicos y clínicos. Nuestra propuesta incluye esa mutagénesis letal de una manera más sofisticada, diseñando el tipo de mutaciones que se van a introducir, con objeto de hacer más daño al virus. Además, se va a combinar con unos péptidos que van a inhibir la capacidad correctora que tiene este coronavirus, algo especial que casi ningún virus de ARN tiene, pero pretendemos bloquearla para que se introduzcan todavía más mutaciones. Como este coronavirus tiene un ARN más grande que otros virus es más sensible a la mutagénesis. Por último, usaremos un inhibidor de una enzima que protege un extremo del ARN, con lo que facilitaremos que la primera línea de defensa del sistema inmune sea capaz de reconocer el virus y pueda eliminarlo de forma rápida».
Isabel: [Despedida y cierre].

