El metabolismo de la glucosa es la ruta metabólica mejor conocida. La especificidad y eficiencia de sus enzimas es extrema. Sin embargo, dos de ellas presentan efectos colaterales con actividad alostérica. En concreto, GAPDH produce 4PE en pequeñas cantidades y PK hace lo mismo con 2PL. Para evitar la acumulación estos subproductos son metabolizados por la enzima PGP/PHO13. La existencia de estos efectos colaterales nos recuerda que, en ciencia, lo mejor conocido también oculta misterios.
El artículo es François Collard, Francesca Baldin, …, Guido T Bommer, «A conserved phosphatase destroys toxic glycolytic side products in mammals and yeast,» Nature Chemical Biology 12: 601–607 (13 Jun 2016), doi: 10.1038/nchembio.2104; un buen resumen en Maria V Liberti, Jason W Locasale, «Metabolism: A new layer of glycolysis,» Nature Chemical Biology 12: 577–578 (19 Jul 2016), doi: 10.1038/nchembio.2133.
Todas las células obtienen energía (moléculas de ATP) gracias a la oxidación de la glucosa (que se transforma en dos moléculas de piruvato). En la primera etapa de la glucólisis se consumen dos ATP, pero en la segunda etapa se producen cuatro ATP. Como resultado la glucólisis produce dos ATP por cada molécula de glucosa. La ruta metabólica de la glucólisis está muy bien conservada en todos los seres vivos. Quizás por ello su eficiencia es muy alta. Sin embargo, existen efectos colaterales. Algunas de las enzimas de la glucólisis catalizan reacciones alternativas, produciendo productos secundarios que pueden inhibir otras enzimas de la propia ruta si no son metabolizados por otras enzimas.
Estudios recientes descubrieron que el metabolito 2-hidroxiglutarato (2HG), producido por ciertos cánceres asociados a mutaciones de IDH1 y/o IDH2, parece ser un producto secundario de las enzimas lactato deshidrogenasa A (LDH-A) y fosfoglicerato deshidrogenasa (PHGDH). Esta última interviene en la glucólisis para la síntesis de serina. Un nuevo trabajo en Nature Chemical Biology ha buscado otros efectos colaterales en la glucólisis.
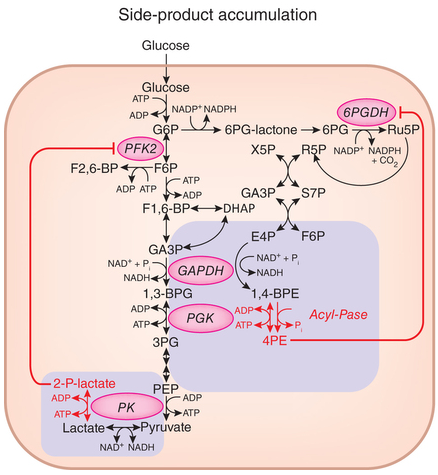
Se han encontrado efectos colaterales en la actividad catalítica de las enzimas gliceraldehído fosfato deshidrogenasa (GAPDH), la enzima que cataliza la sexta etapa en la glucólisis, y piruvato quinasa (PK), la enzima que cataliza el último paso de la glucólisis. GAPDH, además de la fosforilación oxidativa de la gliceraldehído-3-fosfato (GA3P) para generar 1,3-difosfoglicerato (1,3BPG), también cataliza la fosforilación oxidativa de la eritrosa-4-fosfato para producir 1,4-bisfosfoeritronato (1,4BPE), que se desfosforila para producir 4-fosfoeritronato (4PE). Por otro lado, PK, además generar ATP y piruvato fosforilando ADP usando como sustrato el fosfoenolpiruvato (PEP), también puede usar como sustrato el lactato para generar 2-fosfolactato (2PL). En ambos casos, el efecto colateral es debido a que el sustrato alternativo es un análogo estructural del sustrato específico en la ruta de la glucólisis.
La actividad colateral de las enzimas GAPDH y PK está muy suprimida (un millón de veces menos que su actividad en la glucólisis). Aún así, para impedir la acumulación de sus productos secundarios 4PE y 2PL hay enzimas específicas que los metabolizan. El nuevo estudio ha identificado a la fosfoglicolato fosfatasa (PGP/PHO13) capaz de metabolizar 4PE y 2PL. La eliminación de esta enzima usando el método CRISPR-Cas9 provoca una acumulación perniciosa de 4PE y 2PL que inhibe otras enzimas. En concreto, 4PE parece inhibir la deshidrogenasa de glucosa-6-fosfato (6PGDH), una enzima en la rama oxidativa de la ruta de la pentosa fosfato (PPP), y 2PL parece inhibir la fosfofructoquinasa 2 (PFK2), una enzima implicada en la generación de la fructosa 2,6 bifosfato, que es un efector alostérico que aumenta la actividad de la enzima glicolítica fosfofructoquinasa 1 (PFK1).
Las consecuencias fisiológicas y la posible utilidad biomédica de estos efectos colaterales en la glucólisis todavía está por dilucidar. No se conocen los detalles estructurales de la acción alostérica de 4PE y 2PL. Tampoco cómo se regulan los nuevos bucles de realimentación descubiertos. Ni cómo afecta a diferentes órganos, como a las células del hígado en condiciones de ayuno. Liberti y Locasale, en su News & Views, sugieren que la fosfoglicolato fosfatasa podría jugar un papel en la protección contra ciertas enfermedades como el cáncer o el envejecimiento. Pero lo importante es que se han descubierto nuevos mecanismos alostéricos en la glucólisis debidos a efectos colaterales que no se conocían. Conforme más sabemos sobre el metabolismo celular más complicado se nos muestra.
Esta entrada está dedicada a mis alumnos de Bioquímica en la Universidad de Málaga. Excelentes alumnos, sin lugar a dudas.


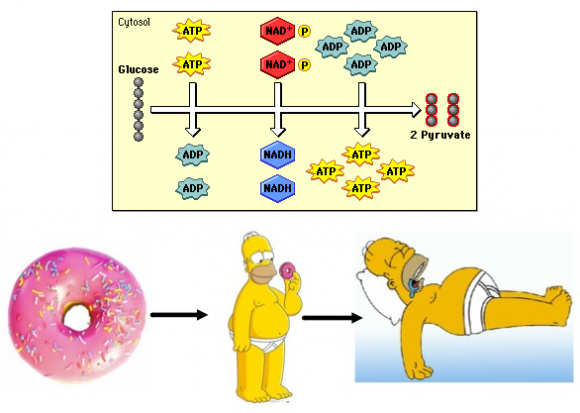

Hay que entender que una cosa es ver las rutas metabólicas en esquemas lineales donde parece todo tan claro, como si fuera la cadena de producción de una fábrica, y otra el cachondeo de moléculas y enzimas en el citoplasma, todas mezcladas, y que sin embargo no colapsan, sino que las reacciones se mantienen continuamente. Es decir, que estar vivo parece un milagro si no lo vemos bajo el prisma de la evolución.
La enzimas son catalizadores que sirven para acelerar y equilibrar el cáos del metabolismo, que en pequeñísimas cantidades pueden controlar la acción de las biomoléculas pero todo exceso trae efectos colaterales imposible de controlar aunque se conviertan en inhibidores enzimáticos como los medicamentos.