El oganesón (Og), antes ununoctio (Z=118), es el elemento sintético más pesado, hasta ahora, de la tabla periódica. El estudio teórico de su estructura electrónica ha mostrado una inesperada sorpresa: no es un gas noble desde el punto de vista químico (como el resto de elementos del grupo 18). Sus electrones no se disponen en capas con nivel energético bien definido, sino que se distribuyen de forma casi continua, como en un gas de Thomas–Fermi. La razón es la fuerte interacción mutua entre sus electrones, que deben ser descritos mediante la ecuación de Dirac, pues se mueven a velocidades relativistas.
Sintetizado en 2002, el oganesón es radiactivo y su vida media es menor de un milisegundo. Por ello, la validación experimental de esta predicción teórica es muy complicada; por cierto, ha sido obtenida usando el llamado método de la localización de fermiones aplicado a la ecuación de Dirac. Este método, que se usa para predecir la estructura energética de los núcleos atómicos, se usa por primera vez para los estados electrónicos de un elemento superpesado. La razón del comportamiento tan raro de este elemento es su acoplamiento espín-órbita, más fuerte que para los gases nobles xenón (Xe) y radón (Rn). Sin lugar a dudas este descubrimiento estimulará el estudio de las propiedades físico-químicas de los elementos superpesados.
El artículo es Paul Jerabek, Bastian Schuetrumpf, …, Witold Nazarewicz, «Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit,» Phys. Rev. Lett. 120: 053001 (31 Jan 2018), doi: 10.1103/PhysRevLett.120.053001, arXiv:1707.08710 [nucl-th]; más información divulgativa en Angela K. Wilson, «Heaviest Element Has Unusual Shell Structure,» Physics 11: 10 (31 Jan 2018) [link], y en Ryan F. Mandelbaum, «Heaviest Element Should Completely Subvert the Rules of High School Chemistry,» Gizmodo, 07 Feb 2018.
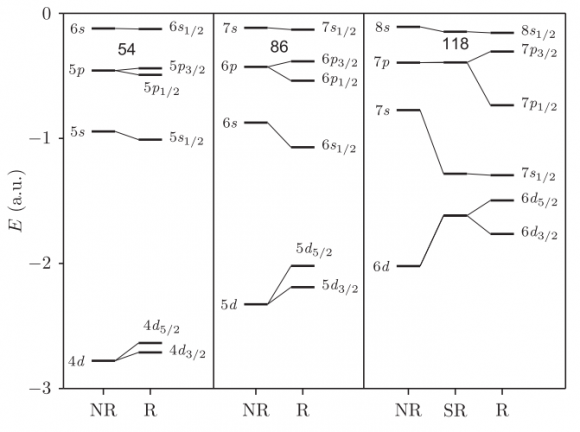
Como ya sabrás de tus estudios elementales de química, los electrones en los átomos se organizan en orbitales o capas (s, p, d, f, etc.). Para el xenón tenemos Xe (Z=54) = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6, para el radón Rn (Z=86) = [Xe] 4f14 5d10 6s2 6p6, y para el oganesón Og (Z=118) = [Rn] 5f14 6d10 7s2 7p6. Un cálculo relativista (R) usando la teoría de Dirac-Hartree-Fock rompe la degeneración energética de estos niveles atómicos en la aproximación no relativista (NR) de Fock y en la relativista escalar (SR) de Hartree-Fock.
Todos los orbitales electrónicos del oganesón están completos, luego se esperaría que fuera un gas noble (como el xenón o el radón). Sin embargo, los efectos relativistas conducen a un fuerte acoplamiento espín-órbita de la capa 7p (con una energía de unos 10 eV). Como resultado, el oganesón tiene una afinidad electrónica positiva de 0,064 eV (como curiosidad, la electrodinámica cuántica da cuenta de unos 0,006 eV).
El estudio experimental del oganesón por métodos químicos no es posible en la actualidad. El elemento más pesado que se puede estudiar de este modo es el flerovio (Z=114) cuya vida media está entre 1 y 2 segundos, lo que permite estudiar su química a un ritmo de 5 átomos por día. La vida media del oganesón (Z=118) está entre 0,31 y 1,07 milisegundos, lo que hace imposible usar los métodos químicos actuales.
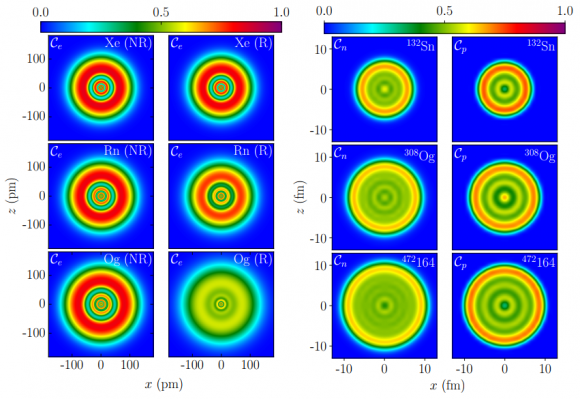
Para el estudio teórico de la estructura electrónica del oganesón se puede usar el método de la localización de fermiones (FLM, siglas de Fermion Localization Method) que determina la llamada Función de Localización Electrónica (ELF). Este método permite estimar la probabilidad de localizar un electrón a cierta distancia del núcleo; los niveles electrónicos se observan como picos donde la probabilidad se acerca a la unidad. La parte izquierda de esta figura muestra la ELF para cálculos no relativistas (NR = Hartree-Fock ) y relativistas (R = Dirac-Coulomb) para los elementos Xe (arriba), Rn (centro) y Og (abajo). El cálculo no relativista y el relativista dan resultados muy parecidos para Xe y Rn, pero muy diferentes para el Og.
Para el oganesón, en el cálculo relativista, cuesta mucho distinguir los niveles electrónicos, estando sus electrones muy deslocalizados. El comportamiento observado es muy parecido a un gas de electrones homogéneo, que a su vez se parece al gas de nucleones (protones y neutrones) que aproxima los niveles energéticos de los núcleos. La parte derecha de esta figura muestra la NLF (Nuclear Localization Function), calculada por el método FLM, para neutrones Cn y protones Cp en los núcleos de 132Sn, 308Og y el hipotético 172164. La NLF para estos núcleos se suele interpretar como un gas de fermiones; la analogía entre estas NLF y la ELF del Og indica que en este caso sus electrones también se comportan como un gas de fermiones.
En resumen, un resultado interesante, por lo inesperado, que nos muestra que la química de los elementos más pesados nos ofrece muchas sorpresas.



El Xenón es 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6
Hacen copie-paste o de verdad se saben las capas de memorias, que loco.
Elemental querido Watson, no se puede pasar de 4s2 4p6 a 6s2 6p6 saltándose 5s2 5p6
Gracias, Daniel, por estar atento.
Buen trabajo!
Podes decirme de manera simple por que el Oganeson no es un gas noble?
Patricia, el oganesón (Og-118) está en la columna de los gases nobles de la tabla periódica. Sin embargo, un gas noble es un elemento químico estable que es químicamente inerte. El oganesón no es estable, su vida media es de unos 0.7 milisegundos; así que no tiene sentido cuestionarse si es o no es químicamente inerte. Por tanto, el Og-118 no se comporta como un gas noble.
la configuracion del oganeson se pasa 5s2 y 5p6
Esta cosa es demasiado costosa y cuesta $ 4,000,000,000,000,000,000,000,000 y esto lo sé por este video https://youtu.be/h66rScoVEhI en pocas palabras impresionante
Ese es el Oganesón…
¿Y de qué trata este artículo?