El almacenamiento de la electricidad es el mayor problema de las fuentes discontinuas de energía, como la solar y la eólica. Su uso generalizado requiere usar baterías con gran capacidad, baratas, robustas, duraderas y versátiles (que puedan ser dimensionadas en función de las necesidades de cada caso). Las baterías de flujo redox pueden ser la solución, pero utilizan metales (como el vanadio) de alto coste. Se publica en Nature un nuevo diseño de batería de flujo que utiliza materiales no metálicos solubles en agua como componentes del electrodo. Estos materiales reducen el coste y aumentan la densidad de energía. Su futuro parece muy prometedor. Nos lo cuenta Grigorii L. Soloveichik, «Electrochemistry: Metal-free energy storage,» Nature 505: 163–165, 09 Jan 2014; el artículo técnico es Brian Huskinson et al., «A metal-free organic–inorganic aqueous flow battery,» Nature 505: 195–198, 09 Jan 2014. Información divulgativa en Mark Peplow, «Cheap battery stores energy for a rainy day. Quinone could make flow-battery technology competitive with current storage methods,» News, Nature, 08 Jan 2014.
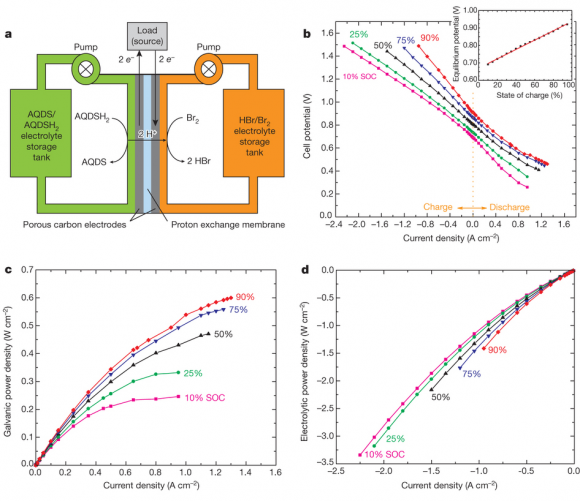
Hoy en día, la solución más barata para el almacenamiento de electricidad es el bombeo de agua desde un depósito bajo a un lugar elevado, pero su uso es imposible en ciertas ubicaciones geográficas. Usar baterías convencionales es una solución muy costosa. Las baterías de flujo redox se basan en separar mediante una membrana (blanca en la figura) dos electrolitos líquidos (verde y violeta) que contienen iones de metales que fluyen a través de electrodos de grafito poroso (gris); la membrana permite el paso de los protones, es decir, el flujo de una corriente entre los electrodos. La gran ventaja de estas baterías es que el fluido electrolítico descargado puede ser reemplazado por otro cargado de forma continua gracias a un simple sistema de bombeo desde dos tanques anexos. El bombeo puede hacerse usando energía renovable (una turbina eólica o una instalación solar). El gran problema de estas baterías es que los metales electroactivos que se utilizan como electrolitos son caros y tienen una baja solubilidad en agua, lo que impide alcanzar densidades altas de energía almacenada.
En 1972 se propuso usar quinonas (C6H4O2) como electrodos, pero estas moléculas orgánicas fueron desechadas porque no son solubles en agua. Brian Huskinson (Univ. Harvard, Cambridge, Massachusetts, EEUU) y sus colegas han usado hidroquinonas, versiones hidratadas obtenidas por reducción a partir de las quinonas, en concreto AQDS (sal de sodio del ácido 9,10-antraquinona-2,6-disulfónico). En el ánodo usan una combinación quinona/hidroquinona y en el cátodo un sistema de bromo/bromuro, que proporciona una buena densidad de energía a un costo razonable (aunque es corrosivo y hostil para el medio ambiente). El diseño permite una gran flexibilidad a la hora de ajustar los potenciales redox y la solubilidad.
Los autores del nuevo trabajo han presentado una «prueba de concepto» mediante una versión pequeña (celda de 2 centímetros cuadrados) de la nueva batería de flujo, que alcanza una densidad de potencia de 600 milivatios por centímetro cuadrado; en principio, nada impide incrementarla combinando múltiples unidades. Por supuesto, el nuevo diseño todavía no puede competir con las baterías de flujo redox con vanadio actuales, que alcanzan una potencia de 25 kW con un tamaño de celda de 0,5 metros cuadrados.
En resumen, los nuevos resultados abren el camino para el almacenamiento de energía de bajo costo, pero hay un largo camino por recorrer para desarrollar una batería de flujo útil en la práctica.



Con toda seguridad digo tonterias.
Yo fui fotografo, de los de antes, de los que teniamos que saber algo de quimica y no bastaba con hojear el manual de una camara para ponerse el titulo de profesional.
Y aunque supongo que no son exactamente los mismos compuesto y son otros miembros de las familias, me ha llamado mucho la atencion que los compuestos citados son casi los mismos que yo formulaba para reveladores y tratamientos especiales.
Las hidroquinonas eran la base de casi todos los reveladores — aunque en BN yo solia usar el beuler —, y los bromo / bromuros, bueno, es obvio.
Probablemente decir quinonas e hidroquinonas es como decir que se usa benceno.
Pero.
Lo que pregunto es: ¿Lo propuesto esta basado en los mismos y conocido procesos de manipulacion de sales metalicas que otrora se usaban en fotografia o no tiene nada que ver?
Mas que nada porque efectivamente, el manejo de estas sustancias era, digamos delicado y bastante toxico. A mi me acompaño el olor en los dedos durante años e incluso alguna mujer arrugo el cociquillo por ello.
Los latex no eran populares y algunos compuestos los deshacian.
En resume: ¿Cambiariamos el almacenamiento de energias teoricamente limpias — hay mucho que decir al respecto, sobre todo en instalaciones masivas — por una contaminacion extensiva y dificilmente evitable?
Ya sabemos que siempre se antempone la rentabilidad a la seguridad y asi son las centrales nucleares peligrosas, no por su naturaleza sino por la chapuza.
Pues eso.
J. Diaz.
Pues no creo que sea casualidad, pero en la naturaleza las quinonas intervienen en la fotosíntesis, en forma de una molécula llamada plastoquinona, y lo hacen como mecanismo redox, es decir como en las baterías del atículo, lo que es doble coincidencia.
Los electrolitos «verde» y «violeta», si como se indica son cationes de vanadio únicamente pueden ser V(II) y V(III) . El catión V(II) es incompatible en medio acuaso; se oxida a estados de oxidación mayores.
¿ Cómo se estabiliza el catión V(II) en medio acuoso ?,
Gracias.
» la membrana permite el paso de los protones, es decir, el flujo de una corriente entre los electrodos. »
Vamos a ver : Los líquidos, tienen iones metálicos.
Iones, no protones.
A menos, que el agua se disocie, y el hidrógeno, de alguna forma, pierda su electrón.
¿Podrías explicarlo?.