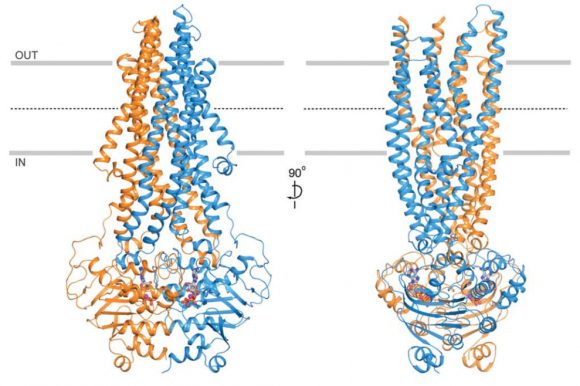
Muchos tumores cancerosos se hacen resistentes a la quimioterapia gracias a proteínas transportadoras de la membrana celular, como la p-glicoproteína (Pgp), que actúan como bombas de expulsión. Las Pgp expulsan una sustancia intracelular fuera de la célula maligna cuando se acoplan a una molécula de ATP. Se publica en Science la estructura tridimensional de esta proteína humana en acción (ligada a una molécula de ATP) determinada por criomicroscopia electrónica. Este resultado ayudará a entender el funcionamiento bioquímico de esta molécula, que defiende a la célula maligna de los efectos de los agentes quimioterapéuticos usados en la clínica. Además, permitirá el desarrollo de bloqueadores de su funcionamiento que acabarán conduciendo a una quimioterapia más eficaz.
El artículo es Youngjin Kim, Jue Chen, «Molecular structure of human P-glycoprotein in the ATP-bound, outward-facing conformation,» Science 359: 915-919 (23 Feb 2018), doi: 10.1126/science.aar7389.
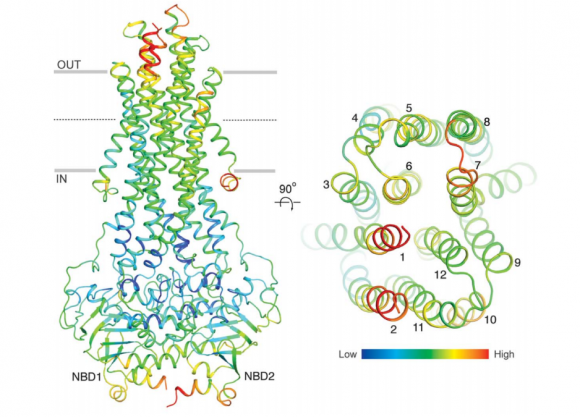
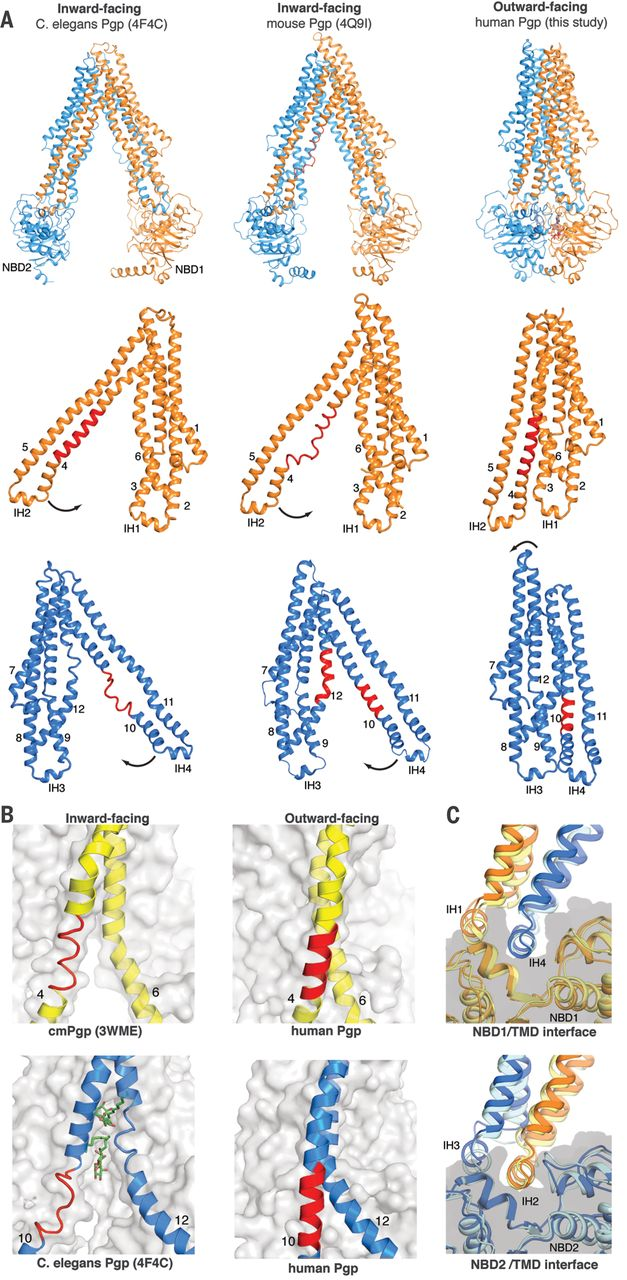
La estructura de Pgp muestra una gran flexibilidad conformacional , lo que permite el transporte unidireccional (hacia afuera) de un gran número de diversas sustancias (sustratos). En el estado abierto, los dos dominios ligados a nucleótidos (NBD) están separados y pueden pivotar para modular el hueco del canal al tamaño del fármaco. Tras la unión a ATP, se cierra el hueco por dimerización, reorganizando el canal para la expulsión (transporte hacia el exterior) del fármaco. Las regiones externas de la moléculas son muy flexibles, lo que facilita la liberación del sustrato y el cierre posterior del canal.
Sin entrar en detalles sobre las hipótesis de funcionamiento de estas bombas de expulsión de fármacos, me gustaría destacar que la conformación de la Pgp humana ligada a ATP difiere de la determinada para el nemátodo C. elegans y el ratón. El conocimiento de la molécula humana resulta clave para un diseño fiable de bloqueadores precisos de su acción. La criomicroscopia electrónica (Premio Nobel de Química 2017) está revolucionando nuestro conocimiento de las proteínas transmembrana que transportan sustancias entre el interior y el exterior de la célula.


Me parece curioso o casi asombroso que pueda actuar con muchas moléculas distintas sin mostrar especificidad. ¿A qué sitios de la proteína se unen las moléculas que van a ser translocadas, o no necesitan unirse temporalmente? No sé si habrá algo en común en las moléculas que puede expulsar, o «cualquier cosa» que entra es echada al otro lado de la membrana, solo importa que quepa en el hueco de la cara interna
Ojala, primer paso y dejar el cancer como una enfermedad, en el peor caso, recurrente.