Ya está disponible el audio del podcast de Eureka, mi sección en La Rosa de los Vientosde Onda Cero. Como siempre, una transcripción, unos enlaces y algunas imágenes.
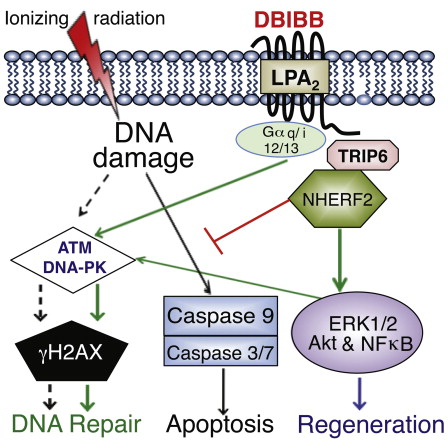
Nuevo fármaco para frenar los daños por radiación. Se ha probado con éxito en ratones y células humanas un medicamento llamado DBIBB podría usarse para tratar a trabajadores de centrales nucleares tras un accidente, enfermos de cáncer sometidos a radioterapia, e incluso para proteger a los astronautas en sus viajes espaciales. Los cánceres más agresivos son resistentes a la radioterapia gracias a un compuesto llamado LPA. El nuevo fármaco es un agonista de LPA desarrollado mediante química computacional. Los resultados in vivo en ratones e in vitro en células humanas son muy prometedores. Este fármaco podría dar lugar a un futuro medicamento radioprotector.
El artículo científico es Renukadevi Patil et al., «Combined Mitigation of the Gastrointestinal and Hematopoietic Acute Radiation Syndromes by an LPA2 Receptor-Specific Nonlipid Agonist,» Chemistry & Biology 22: 1-11, 19 Feb 2015 [open access]. Esta noticia está inspirada en Javier Salas, «Un medicamento pionero es capaz de frenar los daños de la radiación,» Materia, El País, 22 ene 2015. Más información básica sobre el tema en Ernesto Rivera Sánchez, «Radioprotectores,» Radiobiología 10: 225-229, 2010.
En uno de los episodios de la serie de televisión Star Trek se usa un medicamento llamado hyronalina capaz de frenar los efectos de la exposición a la radiactividad en las células humanas. Algo muy útil en accidentes nucleares como Fukushima y Chernóbil. ¿Esta la Medicina actual lejos de desarrollar un fármaco así? Los medicamentos para frenar o reducir los efectos de las radiaciones ionizantes no sólo son útiles en caso de accidente nuclear, también son fundamentales para los astronautas en viajes espaciales de larga duración, como un viaje a Marte, e incluso para mitigar los efectos de la radioterapia en enfermos de cáncer. Por ello se están estudiando con intensidad. Esta semana ha sido noticia que el grupo de investigación de Gábor Tigyi, del Centro de Ciencias de la Salud de la Universidad de Tennessee, EEUU, un medicamento capaz de mitigar los efectos de la radiactividad. El fármaco se ha desarrollado a partir de un compuesto natural que se produce en la sangre y que favorece la cicatrización, llamado LPA. Las pruebas se han realizado in vivo en ratones e in vitro, en laboratorio, en tejidos humanos. El fármaco mantuvo vivos al 93% de los animales tratados, incluso tras iniciar el tratamiento 72 horas (tres días) después de la exposición a la radiación. Todavía no se han hecho pruebas en humanos, pero no tardarán, pues su uso para mejorar la calidad de vida de los enfermos de cáncer tratados con radioterapia es muy prometedor.
Hoy en día en caso de accidente nuclear, como el reciente de Fukushima, ¿hay algún tratamiento médico que se use para tratar a las personas expuestas a la radiactividad? En caso de accidente nuclear hoy en día el único medicamento específico que se usa son las pastillas de yodo. El yodo satura la la glándula tiroides e impide que absorba el yodo radiactivo. Pero este tratamiento se dirige a un único órgano. Se usan otros medicamentos que no son específicos para aliviar los síntomas, según se vayan produciendo fallos en distintos órganos. La radiación ionizante causa la muerte de las células del organismo y afecta al ADN, provocando graves daños en las personas expuestas. Para minimizar los efectos de la radiación se necesitan medicamentos radioprotectores. Hoy en día la mayoría se usan en el ámbito militar, para proteger la salud de los soldados antes de quedar expuestos a la radiación, pero que son poco útiles tras un accidente nuclear. El estudio de los radioprotectores comenzó en EEUU en 1959 gracias a la guerra fría. Durante la década de los 1960 se propuso el uso de unos compuestos químicos llamados aminotioles, como la cisteína y la amifostina, pero debían ser administrados antes de la irradiación para proteger a las células sanas. Estos fármacos tienen efectos secundarios y reacciones adversas, como nauseas, vómitos e hipotensión. Hoy en día, fuera del ámbito militar, el único radioprotector aprobado por la FDA (la Agencia de Alimentos y Medicamentos del gobierno de los Estados Unidos) es la amifostina. Su uso se limita a la práctica clínica en los hospitales donde sus efectos adversos pueden ser manejados. La amifostina está aprobada para tratar la xerostomía (sequedad de la boca) en pacientes que reciben radioterapia por cánceres de cabeza y cuello. Esta sequedad en la boca deteriora la capacidad del paciente para hablar, masticar, tragar y saborear y, por tanto, puede tener un grave efecto negativo sobre su calidad de vida.
La amifostina sólo se usa para tratar a enfermos de cáncer de cabeza y cuello que reciben radioterapia, ¿por qué no se usa para tratar a otros enfermos de cáncer? Todo fármaco para un uso concreto puede ser usado por los médicos para tratar otros problemas, siempre y cuando crean que puede ser útil. La amifostina está aprobada para aliviar los problemas de sequedad bucal, pero también se suele usar reducir los efectos nocivos de la quimioterapia sobre las riñones en mujeres con cáncer de ovario y otros usos. El problema fundamental son sus efectos secundarios: presión arterial baja (hipotensión) y náuseas o vómitos (que pueden ser graves). La amifostina es un compuesto sulfhidrilo orgánico capaz de reducir la formación de radicales reactivos de oxígeno, por ejemplo, inactivando radicales libres de hidroxilo (OH), antes de su interacción con el ADN del núcleo de las células. El radioprotector ideal debe preservar la eficacia antitumoral de la radioterapia, además proteger los tejidos sanos y órganos, tener baja toxicidad y una buena relación coste/efectividad. La amifostina y otros sulfhidrilos están lejos de ser el fármaco ideal.
El nuevo fármaco para mitigar los efectos de la radiactividad tras un accidente nuclear o de la radiacion en los enfermos de cáncer sometidos a radioterapia parece un avance trascendente en este campo. ¿Cómo funciona este compuesto? El nuevo fármaco desarrollado por el equipo de investigacion dirigido por Gábor Tigyi, de la Universidad de Tennessee, EEUU, propicia la reparación de ADN dañado por la radiación ionizante. Los experimentos en ratones indican que detiene la progresión de la muerte celular, la apoptosis, dando margen a las células para reparar su ADN y curarse a sí mismas de los efectos de la radiación. Además, parece promover el crecimiento celular y la regeneración de tejidos. El nuevo compuesto radioprotector se llama DBIBB y es una molécula orgánica complicada de formular (un ácido benzoico con grupos butilsulfamoilo y benzoisoquinolin-2-ilo). En laboratorio, in vitro, mejoró la supervivencia de células sanguíneas e intestinales de ratones y seres humanos sometidos a irradiación. In vivo se ha probado en ratones, logrando mantener vivos al 93% de los ratones tratados, cuando sólo el 20% sobrevive sin tratamiento. Además, el tratamiento es eficaz incluso al ser aplicado 72 horas después de la exposición a la radiación. Hasta el momento no había medicamentos radioprotectores capaces de actuar tan tarde y estos primeros ensayos son convincentes. Una empresa ha comprado la patente del fármaco y pretende realizar pruebas en humanos, pacientes con cáncer sometidos a tratamiento por radioterapia. Por supuesto, garantizar la seguridad del fármaco y determinar en detalle sus efectos secundarios pueden requerir muchos años de pruebas.
Este nuevo fármaco también servirá para proteger a los astronautas en un futuro viaje a Marte de la radiación de rayos cósmicos. ¿Cómo puede ayudar este fármaco a las misiones espaciales? En la Tierra nos protege la atmósfera, pero en el espacio profundo los rayos cósmicos y el viento solar son un peligro para la salud porque incrementan el riesgo de contraer algún tipo de cáncer en lo que resta de vida. Este hecho es el factor que más limita la duración de la estancia de los astronautas a bordo de la Estación Espacial Internacional (ISS). Las tripulaciones deben permanecer en órbita menos de seis meses para minimizar su riesgo según el criterio de la NASA. La dosis total de radiación que puede recibir un astronauta a lo largo de su carrera no debe incrementar la probabilidad de sufrir un cáncer mortal en más de un 3% (el límite llamado REID, por Risk of Exposure-Induced Death). La duración de una misión hacia Marte está limitada por este criterio a unos 300 días para hombres no fumadores y unos 220 días para los fumadores, y a unos 230 días para mujeres no fumadoras y unos 150 días para las fumadoras. La diferencia entre hombes y mujeres es debido a que las mujeres tienen una tolerancia a la radiación menor que los hombres. Las mujeres son más sensibles por sus glándulas mamarias, los ovarios y el útero. Para una futura misión a Marte la diferencia entre hombres y mujeres no es muy grande. Se espera que los medicamentos radioprotectores resuelvan este problema y permitan que los primeros colonos de Marte sean de ambos sexos con igual riesgo ante la radiación.
Más información sobre este tema en Daniel Marín, «#LunesTetas: La relación entre las tetas y el viaje a Marte (o por qué es más probable que la primera persona en pisar el planeta rojo sea un hombre),» Eureka, 12 Ene 2015.







Hay un punto que me resulta confuso, al comienzo del artículo: «Los cánceres más agresivos son resistentes a la radioterapia gracias a un compuesto llamado LPA. El nuevo fármaco es un agonista de LPA».
¿Estamos hablando de que el fármaco evitaría la resistencia de los cánceres a la radiación a la vez que protege a otras células de la degradación por la misma? ¿O que el mismo sistema que protege a los cánceres contra la radiación se puede usar para proteger a las células sanas, y la investigación en la eliminación de la barrera de la resistencia ha conducido a la pista sobre un mecanismo para mejorar la protección en general?