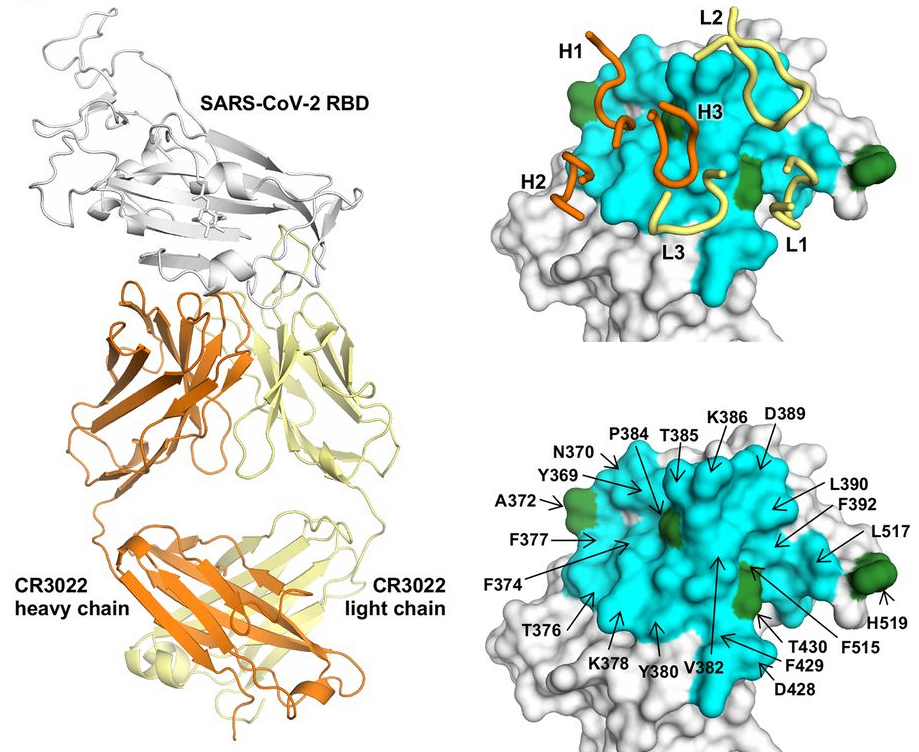
El coronavirus SARS-CoV-2 que causa la enfermedad COVID-19 se parece mucho al coronavirus SARS-CoV que causa el síndrome SARS. El anticuerpo CR3022 fue aislado en un paciente con SARS convaleciente. Se publica en Science la estructura cristalina del complejo CR3022/SARS-CoV-2 RBD con una resolución de 3.1 Å. Dicho anticuerpo se une al dominio de unión al receptor (RBD) de la proteína espicular (S) de SARS-CoV-2, aunque con una afinidad algo menor que a la de SARS-CoV. Su antigenicidad es menor contra COVID-19 que contra SARS, pero podría ser la base para el desarrollo futuro de vacunas «universales» para todos los betacoronavirus de la familia de SARS que infectan a humanos, tanto los ya conocidos, como los que aparecerán en el futuro. También podría ser usado como terapia basada en anticuerpos monoclonales.
La actividad antigénica de CR3022 contra el nuevo coronavirus, como terapia potencial contra COVID-19, ya se publicó a principios de año (Xiaolong Tian, Cheng Li, …, Tianlei Ying, «Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody,» Emerging Microbes & Infections 9: 382-385 (17 Feb 2020), doi: https://doi.org/10.1080/22221751.2020.1729069). El nuevo artículo muestra los detalles de la unión entre este anticuerpo y el dominio de unión al receptor del coronavirus. La biología estructural nos permite entender las diferencias entre su acción y la de otras anticuerpos contra SARS. Sin lugar a dudas, aprender cómo funcionan las cosas es imprescindible para aprender a diseñar cosas que funcionen mejor.
El nuevo artículo es Meng Yuan, Nicholas C. Wu, …, Ian A. Wilson, «A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV,» Science (03 Apr 2020), doi: https://doi.org/10.1126/science.abb7269, bioRxiv (14 Mar 2020), doi: https://doi.org/10.1101/2020.03.13.991570.
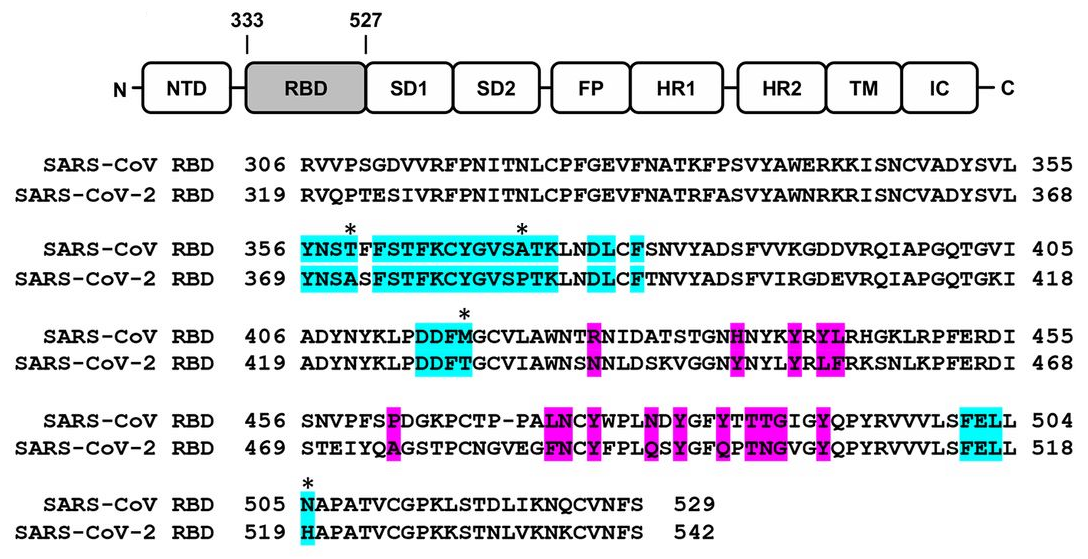
La homología (semejanza debida a la existencia de un ancestro común) entre las secuencias de los residuos de ambos coronavirus a los que se une CR3022 permite que este anticuerpo sea eficaz contra ambos coronavirus. Esta figura muestra el alineamiento de las secuencias de aminoácidos del RBD de los coronavirus SARS-CoV (SARS) y SARS-CoV-2 (COVID-19). En color celeste (cyan) se muestran los 28 residuos (aminoácidos) a los que se une el anticuerpo CR3022 (de los que 24 coinciden en ambos coronavirus); en color morado (magenta) se presentan los residuos clave para la unión con la enzima convertidora de angiotensina humana (hACE2).
La afinidad de CR3022 con el RBD de SARS-CoV es mayor que con el RBD de SARS-CoV-2. La razón tiene que encontrarse en los 4 residuos que los diferencian (marcados con asterisco en la figura). La diferencia más relevante es la Ala (A372) de SARS-CoV-2, en un lugar donde SARS-CoV tiene una Thr (T359); esta alanina induce un sitio de N-glucosilación en el residuo N370 (que no tiene la RBD de SARS-CoV); a dicho sitio puede unirse un glicano (polisacárido) que dificulta la unión de RBD con CR3022 para SARS-CoV-2. El artículo presenta resultados de experimentos in vitro que apuntan a que esta pequeña diferencia es suficiente para explicar la afinidad diferencial de CR3022; por supuesto, los autores no descartan otras explicaciones adicionales.

Observa de nuevo la figura de arriba que muestra el alineamiento de las secuencias de RBD de los dos coronavirus. Los residuos celestes se encuentran a ambos lados de los morados. Un lector incauto podría pensar que la actividad antigénica de CR3022 consiste en ocultar a nivel de estructura primaria la región de unión con hACE2; sin embargo, esto es falso, la función biológica proviene de la estructura terciara (o tridimensional). Nos lo ilustra muy bien esta figura que muestra (arriba) que la unión de CR3022 con RBD de SARS-CoV-2 no interfiere con el sitio de unión de hACE2 con dicho RBD. En la misma figura (abajo) puedes ver así ocurre con la unión de RBD a otros tres anticuerpos (F26G19, 80R y m396); la figura los muestra superpuestos, pues lo único que se pretende ilustrar es la diferencia de su acción antigénica con la de CR3022.
Me gusta esta figura porque ilustra la importancia en biología estructural de contemplar las cosas a nivel global. Si solo se tiene en cuenta el RBD parece imposible comprender cómo es posible que el anticuerpo CR3022 pueda actuar. Sin embargo, el árbol que tenemos enfrente no nos debe impedir el bosque que hay detrás. En este blog me hice eco de la estructura tridimensional del receptor hACE2 (LCMF, 07 mar 2020); como recordarás, era un trímero y se había cristalizado con un monómero en estado «arriba» y dos monómeros en estado «abajo». Si CR3022 no dificulta la unión del RBD con el monómero en estado «arriba», entonces debe bloquear dicha unión apoyándose de alguna forma en los monómeros en estado «abajo». Esta es la hipótesis que han estudiado los autores del nuevo artículo en Science.

En esta figura, arriba a la izquierda, se observa el homotrímero de hACE2 con un mónomero en estado «arriba» (azul oscuro) y dos monómeros en estado «abajo» (naranja). Abajo a la izquierda se muestra un modelo de la acción de CR3022 (amarillo) interfiriendo la unión entre el RBD y la hACE2 en estado «arriba» gracias a que se enfrenta (clash) a los dos monómeros de la hACE2 en estado «abajo» en al menos tres lugares (llamados clash 1, clash 2 y clash 3 en la figura); así, aleja el RBD de la hACE2 en estado «arriba». Más aún, la figura de abajo a la derecha muestra que CR3022 impide la unión incluso si dos de los monómeros de la hACE2 están en estado «arriba» (aunque solo en dos lugares, clash 1 y clash 2). Por desgracia, si los tres monómeros estuvieran en estado «arriba» CR3022 no tendría efecto (no se puede descartar a día de hoy que alguna mutación futura favorezca esta posibilidad).
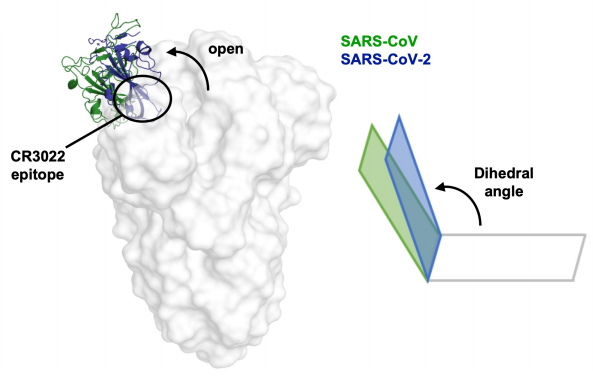
Esta figura ilustra la diferencia entre la conformación «arriba» (a veces se llama «hacia arriba») de la proteína S de SARS-CoV (verde) y SARS-CoV-2 (azul). Se observa un ángulo dihédrico de unos 100º para SARS-CoV-2 y de unos 125º para SARS-CoV; así, el estado «arriba» del nuevo coronavirus apunta más hacia arriba. Otros anticuerpos que dificultan la unión con mónomero en estado «arriba» tienen una afinidad muy diferente entre ambos coronavirus. Gracias a que CR3022 actúa por enfrentamiento (clashing) con los monómeros en estado «abajo» su afinidad es similar. Los lectores interesados en más detalles estructurales pueden consultar el artículo en Science que es open access (o el manuscrito en bioRxiv).
En resumen, un bello trabajo de biología estructural sobre el coronavirus SARS-CoV-2 que causa la COVID-19. Entender la acción de los anticuerpos es fundamental para poder diseñar nuevos anticuerpos monoclonales que puedan actuar como antivirales contra COVID-19. Teniendo en cuenta que el desarrollo de anticuerpos monoclonales suele ser más rápido que el desarrollo de vacunas, y que ahora necesitamos con más urgencia terapias que vacunas, me parece un trabajo que hay que tener en cuenta. Por supuesto, habrá que esperar a los resultados de los estudios clínicos, la ciencia aplicada. Sin embargo, para los apasionados a la ciencia básica, lo más fascinante es cómo funcionan las cosas, no para qué sirven.


La operación del sistema inmune es impresionante. Me pregunto cómo serán capaces los linfocitos de «diseñar» los anticuerpos para que se fijen a los antígenos. Me da la sensación de que tienen que diseñar una proteína que se pliegue de la forma adecuada para que encaje sobre el antígeno. Perdón si digo una tontería.
La respuesta la encontré aquí: https://blogs.20minutos.es/ciencias-mixtas/2020/10/11/la-inmunologia-revela-pistas-clave-sobre-la-gravedad-de-la-covid-19/
¿Cómo es posible que nuestros genes puedan fabricar anticuerpos adaptados a la forma de antígenos que antes ni siquiera existían, con los que jamás ningún humano se había topado?
Esta es la respuesta: en los linfocitos B, las células que producen los anticuerpos, los genes encargados de fabricar estas proteínas se reorganizan entre sí al azar, como cuando se utilizan las mismas piezas de Lego para hacer construcciones diferentes (esto se llama recombinación somática). En cada célula individual el resultado es distinto, y por ello cada célula produce un anticuerpo único, con una forma distinta. La consecuencia es que nuestro cuerpo está patrullado en todo momento por millones de células B preparadas para producir millones de anticuerpos distintos contra cualquier cosa, el polen de arizónica, la peste negra, el SARS-CoV-2, el antígeno venusiano o nada en particular.
Hola, intereante articulo para leer con calma, pues no he entendido casi nada.
Dos preguntas.
La Ivermectina actúaria sobre el RNA del COVID19?
Otra pregunta es la siguiente: si una sustancia, por ejemplo X actúa sobre dos receptores farmacológicos, llamémosle R1 y R2. y tiene una Ki de 0.69 nM para Receptor 1 y de CB1 1.2 nM para receptor R2.
Ese concepto de Ki o constante de inhibición significa que actúaagonisticamente más sobre el receptor 1 o el receptor 2. Es una pregunta sencilla, pero no me la se.
Al se la Ki más alta para el Receptor 2, es su unión m´s específica y » mas fuerte»…¿mas afín?
Ki: constante de inhibición ( wikipedia) :binding affinities (Ki) of drugs and chemical compounds for receptors, neurotransmitter transporters, ion channels, and enzymes.
Antihomeópata, mi pieza no menciona la ivermectina. En cualquier caso este antiparasitario (antihelmíntico) interacciona con los canales de sodio de la membrana celular responsables entre otras cosas del pH del interior celular. No se sabe si será útil o no lo será para tratar COVID-19; hasta donde sé su efecto será dificultar la formación de la membrana que recubre el ARN del virus y donde se insertan sus proteínas de membrana. Pero, repito, no se sabe aún si será eficaz contra COVID-19. Que funcione en experimentos in vitro, no implica que funcione en ratones, ni que funcione en simios, ni que funcione en humanos.
No debo contestar tu pregunta sobre la interacción alostérica; en este blog no se resuelven dudas a estudiantes para que realicen sus tareas sin estudiar los libros de texto que les recomiendan sus profesores. Hay cientos de libros sobre enzimología que puedes consultar. Aprovecha el confinamiento para estudiar.
Hola francis
Que pasa despues de levantarse la cuarentena? se vuelve al punto anterior al ponerla? entonces la curva se vuelve a repetir hasta la vacuna?
Buenos días, se sabe por qué los inhibidores de la enzima de angiotensina (AINES), un tratamiento para la hipertensión, no tiene ningún efecto en la unión del virus a la encima. Gracias
Tony, hasta donde me consta no se conoce. Se propuso la hipótesis de que los inhibidores de la ACE inducen una mayor expresión de la ACE2 a la que se acopla el coronavirus; pero las pruebas a favor de hipótesis son muy débiles (https://doi.org/10.1016/S2213-2600(20)30116-8). Demostrar un efecto, si existe, es fácil; demostrar la ausencia de un efecto es extremadamente difícil.
Disclaimer: yo no soy experto en estas lides. Me estoy leyendo muchos artículos científicos sobre CODIV-19. Pero eso no me convierte en experto. Así que mi opinión nunca se debe considerar como opinión de experto.
hola, se me ha adelantado Tony, porque iba a preguntar sobre lo que opinas sobre la up regulation del receptor ACe/2. Mira lo que dice este medico americano. Buen video.https://www.youtube.com/watch?v=qOF5a3I7puQ&fbclid=IwAR0ilkjEd_JvLsnOO1QN9LFT4RZGuNZ9EgzbNQQkMVCluYAxMU3qTrESGy
Heinrich, gracias; no es un medio, es una charla del MIT CSAIL (Computer Science and Artificial Intelligence Laboratory).
hola, estas de acuerdo con Rob Wallace y su libro Big Farms Make Big Flu o me podrias recomendar un articulo sobre enfermedades emergentes y deforestacion y agricultura industrial feed lot
Estos dos tienen como 20 años
https://www.nature.com/articles/nm1150
https://science.sciencemag.org/content/287/5452/443
Benjamin, es irrelevante que yo esté de acuerdo o no, la ciencia no funciona así. Hay muchos artículos sobre el tema, busca, lee y formate tu propia opinión: Google Scholar .
Muy bueno!! Gracias! Todo lo que hay que aprender todavía, Alicia Cámara Investigadora Viróloga de Córdoba Argentina. Referente de Familia Coronaviridae. Trabajando duro, Gracias!!